Pauli-Prinzip
Das Pauli-Prinzip – oder „Pauli-Verbot“ sowie „Paulisches Ausschließungsprinzip“ genannt – ist ein Gesetz aus der Physik, genauer gesagt eines aus dem Bereich der Quantenphysik. Die Entdeckung des Pauli-Prinzips geht auf den österreichischen Wissenschaftler Wolfgang Ernst Pauli zurück, der damit im Jahre 1925 eines der grundlegendsten Prinzipien der Quantenmechanik formulierte.
Kleiner Reminder: Die Quantenmechanik beschäftigt sich mit den Gesetzmäßigkeiten und Zuständen von Materie und wie deren physikalische Eigenschaften berechnet werden können (im Größenbereich von Atomen und darunter). Das macht das Pauli-Prinzip insbesondere für die Chemie relevant.
Pauli-Prinzip: Eine Definition
Im Grunde liegt die Definition des Pauli-Prinzips jenseits der Normierungen, die in der klassischen Physik gelten. Diese geht von der Annahme aus, dass sich zu keiner Zeit feststellen lässt, ob sich zwei Teilchen in einem Atom am gleichen Ort aufhalten oder nicht. Die logische Folge: Sie sind zunächst ununterscheidbar. Wie Experimente belegen, kann man für Orbitale (ausgedehnte Bereiche mit mehreren Teilchen) eine gewisse Wahrscheinlichkeit bestimmen, um zu berechnen, wo sich die Elektronen darin befinden. Die Bereiche überlappen sich gelegentlich, sodass sich auch die Teilchen am selben Ort aufhalten können.
Hier greift nun das Pauli-Prinzip der Physik: Zwei Elektronen können zunächst niemals die gleichen Quantenzahlen besitzen. Diese Messgrößen für die Bewegungseigenschaften eines Elektrons geben Auskunft über Orbital, Drehimpuls und Spin. Das Pauli-Prinzip fixiert, dass sich zwei Elektronen in mindestens einer ihrer Quantenzahlen unterscheiden müssen. Es gilt somit für alle Teilchen mit halbzahligem Spin – Fermionen genannt. Dazu gehören neben Elektronen auch Protonen und Neutronen. Sogenannte Bosonen, die für die Übertragung von Kräften verantwortlich sind, unterliegen dem Pauli-Prinzip hingegen nicht.
Allgemeine Form:
Die Gesamtwellenfunktion 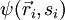 eines Systems von n Fermionen ist total antisymmetrisch bezüglich der Vertauschung zweier Teilchen:
eines Systems von n Fermionen ist total antisymmetrisch bezüglich der Vertauschung zweier Teilchen:
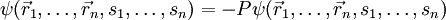
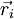 sind dabei der Ort und si der Spinausrichtung des i-ten Fermions. Des Weiteren ist P der Permutationsoperator, der die Vertauschung jeweils zweier Teilchen bewirkt, also ergibt sich die Formel:
sind dabei der Ort und si der Spinausrichtung des i-ten Fermions. Des Weiteren ist P der Permutationsoperator, der die Vertauschung jeweils zweier Teilchen bewirkt, also ergibt sich die Formel:
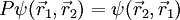 .
.
Die Konsequenz des Pauli-Prinzips
Durch die Charakterisierung der Fermionen im Pauli-Prinzip lässt sich nachweisen, dass stets nur zwei Elektronen außerhalb des Atomkerns in einem Orbital Platz finden können. Aus heutiger Sicht heißt das: Bei Vertauschung von identischen Fermionen wird die Wellenfunktion eines Quantensystems antisymmetrisch. So können genaue Schlüsse über den Aufbau und die Unterscheidung (Periodensystem) der Materie gezogen werden. Zudem ist die Austauschwechselwirkung der Elektronen, die das Pauli-Prinzip festlegt, verantwortlich für den Magnetismus.
Genaue Deutung der Pauli-Regel
Die totale Antisymmetrie einer Wellenfunktion bedeutet, dass sie ihr Vorzeichen wechselt, wenn zwei beliebige Teilchen vertauscht werden. In der Physik bedeutet die Antisymmetrie, dass zwei Fermionen niemals denselben Quantenzustand besetzen können: Stimmen nämlich zwei Fermionen in Ort und Spinquantenzahl überein, verändert eine formale Vertauschung der beiden Fermionen die Wellenfunktion nicht – aufgrund deren Ununterscheidbarkeit. Die einzige Lösung ist dann eine verschwindende Gesamtwellenfunktion wegen Ψ = − Ψ, also Ψ = 0.
Bei einer Separation in Ortswellenfunktion und Spinwellenfunktion fordert die Antisymmetrie der Gesamtwellenfunktion bei symmetrischer Ortswellenfunktion eine antisymmetrische Spinwellenfunktion – und vice versa. Eine (anti)symmetrische Spinwellenfunktion kennzeichnet eine paarweise (anti)parallele Spinorientierung. Die triviale Lösung einer antisymmetrischen Ortswellenfunktion erhalten Sie, wenn sich die paarweisen vertauschten Elementarteilchen am selben Ort befinden (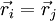 ) .
) .
 Versandkostenfrei ab 75 € Warenwert**
Versandkostenfrei ab 75 € Warenwert**